صحه گذاری و معتبرسازی فرآیند به عنوان جمع آوری و ارزیابی داده ها، از مرحله طراحی فرآیند و در سراسر تولید، تعریف می شود که شواهد علمی مبنی بر اینکه یک فرآیند قادر به ارائه مداوم محصولات با کیفیت است، ایجاد می کند.
صحه گذاری و معتبرسازی فرآیند یکی از الزامات “شیوه های تولید خوب (Good Manufacturing Practices) ” به حساب می آید. این الزام هم برای شرکت های دارو سازی و هم تجهیزات پزشکی الزامی است. به عنوان مثال سازمان غذا و داروی آمریکا تحت قانون شماره 21CFR 211 و21 CFR 820 به ترتیب شرکتهای داروسازی و تولید کنندگان تجهیزات پزشکی را ملزم به صحه گذاری و معتبرسازی فرآیندهای خود کرده است.
صحه گذاری و معتبرسازی فرآیند فرآیند شامل مجموعه ای از فعالیت هایی است که در طول چرخه عمر محصول و فرآیند انجام می شود.
سازمان غذا و داروی ایالات متحده (FDA) دستورالعمل هایی را با تعریف زیر برای صحه گذاری و معتبرسازی فرآیند پیشنهاد کرده است:
– ” صحه گذاری و معتبرسازی فرآیند” ایجاد شواهد مستندی است که درجه بالایی از اطمینان را ارائه می دهد که یک فرآیند خاص به طور مداوم محصولی را مطابق با مشخصات و کیفیت از پیش تعیین شده خود تولید می کند.
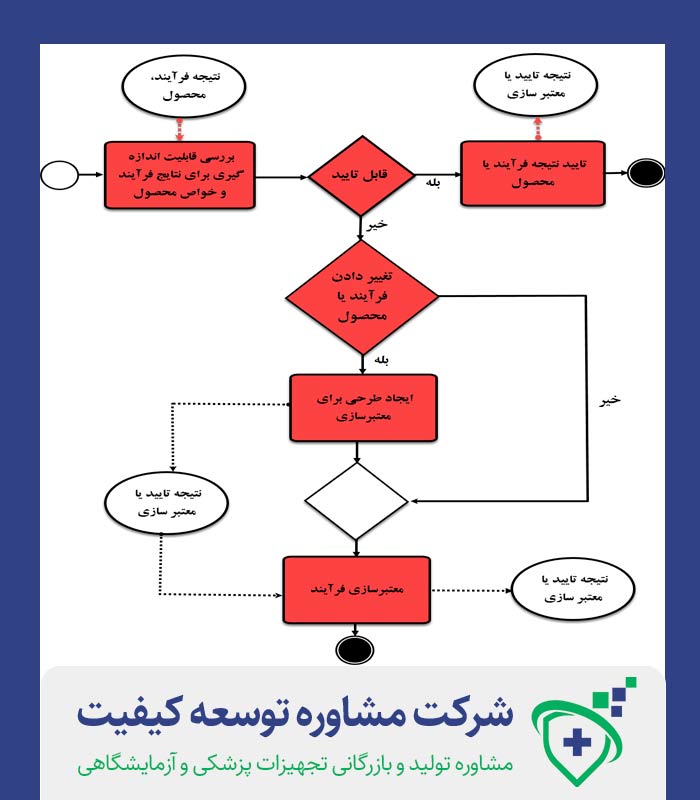
شکل شماره یک: چرخه اصلی معتبر سازی فرآیند
فعالیت های صحه گذاری فرآیند را می توان در سه مرحله توصیف کرد:
مرحله 1 – طراحی فرآیند: فرآیند تجاری در این مرحله تعریف می شود. این تعریف بر اساس دانش به دست آمده از طریق فعالیت های توسعه ای و افزایش تولید به مقیاس، صورت میگیرد.
مرحله 2 – احراز کیفیت فرآیند: در این مرحله، “طراحی فرآیند” در قالب تولید تجاری تکرارپذیر تایید می شود.
مرحله 3 – تصدیق مداوم فرآیند: اطمینان مداوم در طول تولید به دست می آید و باید فرآیند تحت کنترل باقی بماند.
انواع صحه گذاری فرآیند
گایدلاین های بین المللی ، صحه گذاری و معتبر سازی فرآیند را به چهار نوع طبقه بندی میکنند:
• الف) صحه گذاری آینده نگر (یا صحه گذاری قبل از عرضه به بازار)
• ب) صحه گذاری گذشته نگر
• ج) صحه گذاری همزمان
• د) صحه گذاری مجدد
الف) صحه گذاری آینده نگر (یا صحه گذاری قبل از عرضه به بازار)
ایجاد شواهد مستند قبل از استقرار فرآیند مبنی بر اینکه یک سیستم آنچه را که پیشنهاد کرده است بر اساس پروتکل های از پیش برنامه ریزی شده انجام می دهد. این رویکرد صحه گذاری معمولاً زمانی انجام می شود که فرآیند یک فرمول جدید در خط تولید (یا در یک مرکز جدید) باید قبل از شروع تولید معمول تأیید شود. در واقع، صحه گذاری یک فرآیند با این رویکرد اغلب منجر به انتقال فرآیند تولید از حالت توسعه به تولید می شود.
ب) صحه گذاری گذشته نگر
صحه گذاری گذشته نگر برای تجهیزات، فرآیندها و کنترل های فرآیند در استفاده عملیاتی استفاده می شود که تحت یک فرآیند صحه گذاری مستند رسمی قرار نگرفته اند. صحه گذاری این تسهیلات، فرآیندها و کنترلهای فرآیند با استفاده از دادههای گذشته برای ارائه شواهد مستند مبنی بر اینکه فرآیند همان کاری را که تصور میشود، انجام میده. بنابراین، این نوع صحه گذاری فقط برای فرآیندهای تثبیت شده قابل قبول است و در مواردی که تغییراتی به تازگی در ترکیب محصول، فرآیندهای عملیاتی یا تجهیزات ایجاد شده باشد، نامناسب خواهد بود.
این رویکرد امروزه به ندرت مورد استفاده قرار می گیرد زیرا بعید است که محصول موجود تحت فرآیند صحه گذاری آینده نگر مورد ارزیابی قرار نگرفته باشد. صحه گذاری گذشته نگر فقط برای ممیزی یک فرآیندی که قبلا صحه گذاری شده است مورد استفاده قرار میگیرد.
بعنوان مثال امکان دارد که فرآیندی سالها قبل معتبر سازی شده باشد ولی اسناد آن موجود نباشد و یا بنا به دلایل غیر منتظره ای از بین رفته باشند. در این صورت از صحه گذاری گذشته نگر استفاده می شود.
ج) صحه گذاری همزمان
صحه گذاری همزمان برای ایجاد شواهد مستندی استفاده میشود که نشان میدهد تجهیزات و فرآیندها بر اساس اطلاعات تولید شده در طول اجرای واقعی واقعی فرآیند، آنچه را که مد نظر دارند انجام میدهند. این رویکرد شامل نظارت بر مراحل مهم پردازش و آزمایش محصول نهایی خط تولید فعلی است تا نشان دهد که فرآیند تولید در حالت کنترل شده قرار دارد.
د) صحه گذاری مجدد
صخه گذاری مجدد به معنای تکرار صحه گذاری اولیه یا هر بخشی از آن است و شامل بررسی تحقیقی داده های عملکرد موجود است. این رویکرد برای حفظ وضعیت تایید شده کارخانه، تجهیزات، فرآیندهای تولید و سیستم های کامپیوتری ضروری است. دلایل احتمالی برای صحه گذاری مجدد عبارتند از:
• انتقال یک محصول از محل تولید به محل تولید دیگر.
• تغییرات در محصول، کارخانه، فرآیند تولید، فرآیند تمیزکاری یا سایر تغییراتی که می تواند بر کیفیت محصول تأثیر بگذارد.
• لزوم بررسی دوره ای نتایج صحه گذاری.
• افزایش یا کاهش قابل توجه در تولید محصول (بچ تولیدی)
• بچ های متوالی تولیدی که با مشخصات محصول و فرآیند مطابقت ندارند.
• دامنه روشهای صحه گذاری مجدد به میزان تغییرات و تأثیر آن بر محصول بستگی دارد.
جمع بندی
یک فرآیند معتبر نه تنها احتمال نرخ خرابی تولید را کاهش می دهد، بلکه بهره وری تاسیسات تولیدی را به دلیل به حداقل رساندن دوباره کاری افزایش می دهد. نمونه هایی از فرآیندهایی که باید معتبرسازی شوند عبارتند از: استریل کردن، پر کردن به روش آسپتیک، عملیات حرارتی، آبکاری و قالب گیری تزریق پلاستیک. درکنار این موضوع در تمام مراحل چرخه عمر محصول، مدیریت پروژه خوب و بایگانی خوب مستندات که دانش علمی را در بر می گیرد، برنامه معتبر سازی فرآیند را مؤثرتر و کارآمدتر می کند. اقدامات مختلف باید جمع آوری و ارزیابی یکنواخت اطلاعات در مورد فرآیند را تضمین کند و دسترسی به چنین اطلاعاتی را در آینده در چرخه عمر محصول افزایش دهد. ما در شرکت توسعه کیفیت یک رویکرد تیمی یکپارچه را برای صحه گذاری و معتبر سازی فرآیند توصیه می کنیم که شامل تخصص از رشته های مختلف باشد. این افراد در تعامل بایکدیگر و در قالب یک برنامه جامع معتبر سازی فعالیت خواهند کرد و به اهداف از پیش تعریف شده در معتبر سازی فرآیند دست پیدا خواهند کرد. با ما در تماس باشید تا ضمن ارائه یک برنامه جامع معتبر سازی، بتوانید کلیه فرآیندهای خود را صحه گذاری نمایید. مشاورین متخصص و مجرب ما در شرکت توسعه کیفیت، به شما کمک خواهند کرد تا با ایجاد یک ساختار منظم و حرفه ای، پاسخگوی نیازهای سازمان خود و نظام رگولاتوری کشور باشید.
برای آگاهی درباره معتبر سازی تجهیزات و فرآیندهای مختلف می توانید به مطالب زیر رجوع کنید:
صحه گذاری و معتبر سازی اتاق تمیز(کلین روم ولیدیشن)
صحه گذاری چمبر اتیلن اکساید
معتبر سازی و صحه گذاری تجهیزات آزمایشگاه



